Нанокластери, надруковані на 3D-принтері, дозволяють виявляти рак
- 08 вересень 2025 07:45:00
- Переглядів: 554
Дослідники з Пусанського національного університету в Південній Кореї розробили діагностичний метод на основі 3D-друку, який виявляє рак щитовидної залози за допомогою поверхнево-посиленої раманівської спектроскопії (SERS) на сироватці крові людини. Цей метод обходить необхідність використання традиційних біомаркерів, аналізуючи спектральні патерни за допомогою згорткової нейронної мережі (CNN), досягаючи чутливості 93,1% та специфічності 84,0%.
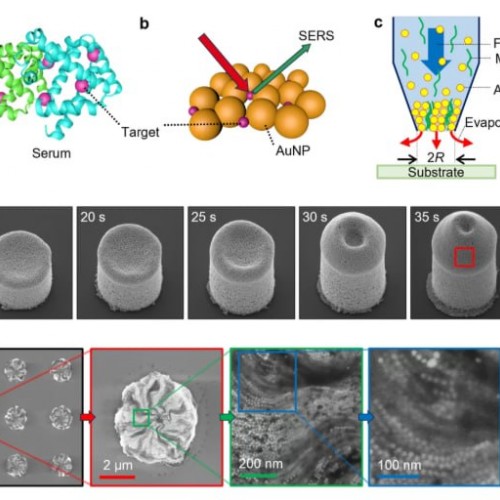
Поточна діагностика раку щитовидної залози спирається на цитологічну біопсію тонкоголкою, що може призвести до неоднозначних результатів та ускладнень. Незважаючи на десятиліття досліджень, для цього захворювання не було підтверджено жодного специфічного біомаркера. Дослідницька група Пусана усунула це обмеження, застосувавши SERS до кластерів наночастинок золота (AuNP), виготовлених безпосередньо з сироватки крові пацієнта за допомогою процесу 3D-друку на основі випаровування. Ці нанокластери підсилюють сигнали Рамана, що генеруються біохімічними сполуками у зразку, що дозволяє алгоритмам глибокого навчання класифікувати випадки з позитивним результатом на рак та здорові випадки без необхідності сигналу біомаркера.
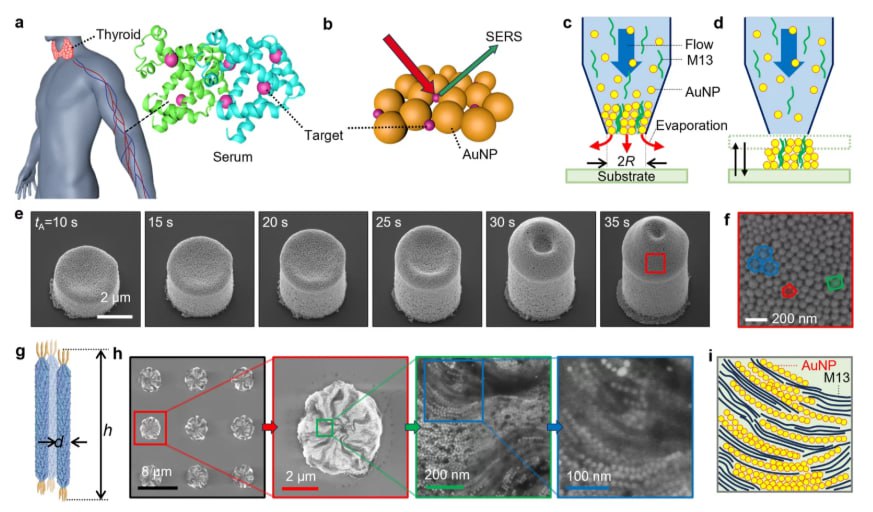
Загалом 100 зразків сироватки крові — 50 від пацієнтів з діагнозом раку щитовидної залози та 50 від здорових осіб — було зібрано з Банку матеріалів людського походження лікарні Янсан Пусанського національного університету. Для створення плазмонного субстрату дослідники поєднали AuNPs (діаметром 75 ± 5 нм), фізіологічний розчин та людську сироватку в гібридну рецептуру чорнила. Фізіологічний розчин був включений для зниження концентрації альбуміну, оптимізуючи умови для кластеризації AuNPs. Чорнило завантажували в мікропіпетку розміром 30 мкм, і осадження здійснювалося шляхом підтримки контакту з кремнієвою підкладкою до тих пір, поки випаровування розчинника не призводило до накопичення наночастинок та утворення кластерів. Енергетико-дисперсійна рентгенівська спектроскопія підтвердила наявність диспергованих AuNPs у висушених структурах, а також спостерігалися кристали хлориду натрію через вміст фізіологічного розчину.
Кожен кластер утворював локалізовані електромагнітні гарячі точки завдяки взаємодії AuNPs. Ці гарячі точки посилювали раманівський сигнал сусідніх метаболітів. Команда записала SERS-спектри за допомогою портативного раманівського спектрометра з лазером 633 нм при потужності 1,8 мВт та 2,0 мВт протягом чотирьох тривалостей експозиції: 500 мс, 1000 мс, 2000 мс та 3000 мс. Загалом було зібрано 800 спектрів, по 400 з кожної групи. Вимірювання проводилися в діапазоні раманівського зсуву від 200 до 1200 см⁻¹, а спайковий шум видалявся перед аналізом; додаткова спектральна фільтрація не застосовувалася. Повторюваність була підтверджена шляхом виконання п'яти вимірювань на зразок, що підтверджує узгодженість спектральних профілів у сироватці крові кожної людини.
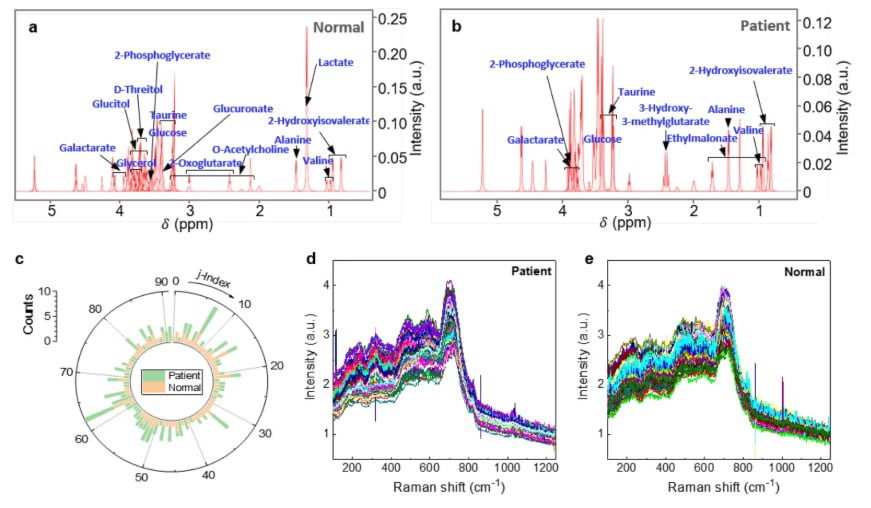
Для оцінки точності класифікації було проведено навчання як 1D, так і 2D моделей CNN для розрізнення спектрів здорових осіб та онкологічних хворих. Кожен спектр був позначений як 0 або 1, а дані були розділені у співвідношенні 8:2 на навчальні та тестові набори. Архітектура 2D CNN включала два згорткові шари (16 та 48 фільтрів) та один щільний шар з 256 нейронами. Використовувався розмір ядра 3×3 з коефіцієнтом відсіву 0,6. Модель використовувала оптимізатор Adam, коефіцієнт навчання 0,0011949 та сигмоподібну функцію активації. Навчання проводилося протягом 80 епох. Отримана площа під кривою (AUC) становила 0,858, і модель продемонструвала стабільну продуктивність у всіх тестових вибірках.
Незважаючи на певні обмеження, метод пропонує шлях уперед для виявлення захворювань у випадках, коли ідентифікація біомаркерів застопорилася. Інтеграція наноструктурованих матеріалів, спектроскопічних показників та машинного навчання дозволила проводити відтворюваний аналіз зразків з використанням мінімальних вхідних обсягів та без інвазивних процедур. Автори зазначають, що подібні методи можуть бути адаптовані до інших захворювань з важкодоступними молекулярними мішенями.